已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 |
Zn(OH)2 |
ZnS |
AgCl |
Ag2S |
MgCO3 |
Mg(OH)2 |
| 溶度积 |
5×10-17 |
2.5×10-22 |
1.8×10-10 |
6.3×10-50 |
6.8×10-6 |
1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是( )
A.2AgCl+Na2S=2NaCl+Ag2S
B.MgCO3+H2O△,Mg(OH)2+CO2↑
C.ZnS+2H2O=Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O
在一定温度下,A2(g) + B2(g)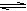 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
①单位时间内减少x mol A2,同时生成2x mol AB;②单位时间内生成 2x mol AB, 同时生成x mol A2;③反应混合物中,A2、B2、AB的物质的量比为1:1:2;④单位时间内1mol A-A键断裂,同时形成2 mol A-B键;⑤单位时间内减少1mol A2,同时断裂2 mol A-B键;⑥反应混合物中,AB的质量分数不再改变。
| A.①③④ | B.②⑤⑥ | C.②④⑥ | D.①⑤⑥ |
某元素X原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子为
A.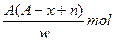 |
B.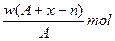 |
C.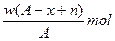 |
D.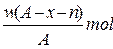 |
下列过程中,共价键被破坏的是
| A.碘升华 | B.溴蒸气被木炭吸附 |
| C.加热NaCl使之融化 | D.碘化氢气体受热分解 |
对于A2 + 3B2=" 2C" + D的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.V(B2)="0.8mol/(" L·s) B.V(D)="0.6mol/(" L·s)
C.V(C)="0.6mol/(" L·s) D.V(A2)="0.8mol/(" L·min)
如下图各装置中均盛有海水,铁在其中被腐蚀由快到慢的顺序正确的是
| A.②>①>③ | B.①>②>③ | C.③>②>① | D.②>③>① |