(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(9分)(1)Na2CO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;(2)氯化铝水溶液呈性,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: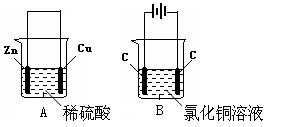
(1)A,B两个装置中,属于原电池的是(填标号)
(2)A池中,铜极为极,发生反应,(填“氧化”“还原”)电极反应式为:。
(3)B池中,左边C是极,电极反应式为:;
总反应式为。
(4)B池中当阴极产生6.4g铜时,阳极放出g气体。
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大。,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍;,B是地壳中含量最多的元素;C元素的焰色为黄色,C的单质一般保存在煤油中;D的M层电子数为K层电子数的3倍。试根据以上叙述回答:
(1)元素名称:A ________ B __________ C __________ D ___________。
(2)写出A与B形成的化合物的电子式:______________。
(3)画出D的离子结构示意图: ___________________。
(4)B的气态氢化物稳定性比D的气态氢化物稳定性______。(填“强”、“弱”或“相同”)
(5)已知4g A的气态氢化物在氧气中完全燃烧生成液态水,放出222.5kJ热量。写出A的氢化物燃烧的热化学方程式。
现有①MgBr2②金刚石 ③NaOH ④KCl⑤干冰五种物质,按下列要求回答(填序号,每空一个答案)
(1)是共价化合物的是______,既有离子键又有共价键的物质是
(2)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________。
元素X最高正化合价为+7,其气态氢化物的化学式为________。某元素R与氢形成的气态氢化物的化学式为H2R,其最高价氧化物的水化物的化学式为____________。