将金属A和金属B分别放入稀H2SO4中有氢气生成。若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀,关于A、B的叙述正确的是( )
A.金属活动性A>B
B.还原性B>A
C.在后者装置中金属A发生还原反应,金属B发生氧化反应
D.金属B的表面有明显的气泡产生
1996年2月,德国某研究所在高能加速器中,将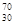 Zn 撞入一个
Zn 撞入一个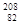 Pb的原子核并释放出一个中子后,合成一种人造超重元素的原子。该元素原子内中子数为( )
Pb的原子核并释放出一个中子后,合成一种人造超重元素的原子。该元素原子内中子数为( )
| A.278 | B.277 | C.166 | D.165 |
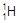 、
、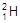 、
、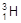 、H+、H2可以表示()
、H+、H2可以表示()
| A.氢的五种同位素 | B.五种氢元素 |
| C.化学性质不同的氢原子 | D.氢元素的五种不同粒子 |
加热N2O5,依次发生的分解反应为:①N2O5(g)  N2O3(g)+O2(g), ②N2O3(g)
N2O3(g)+O2(g), ②N2O3(g) N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为()
N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为()
| A.10.7 | B.8.5 | C.9.6 | D.10.2 |
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应
3M (g) + N (g)  xP (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol·L-1·min-1,则下列说法正确的是()
xP (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol·L-1·min-1,则下列说法正确的是()
| A.方程式中x=2 |
| B.达平衡后,容器内压强是反应起始时的2倍 |
| C.向容器中再充入3.0molM和2.5molN,达新平衡时Q 的体积分数减小 |
| D.容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 |
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用下图装置进行实验探究,下列说法正确的是()

| A.X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B.X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C.X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D.X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |