如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: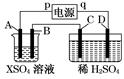
(1)p为 极,A极发生了 反应。
(2)C为 极,可收集到 ;D为 极,可收集到 。
(3)C极的电极反应式为 。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 阴极产生气体 的体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
| 阳极产生气体 的体积(cm3) |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出变化的可能原因是
。
(5)当反应进行一段时间后,A、B电极附近溶液的pH (填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为 。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=mol/(L·min),此时该反应的平衡常数为。
CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)=mol/(L·min),此时该反应的平衡常数为。
(2)T ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c10.08 (填 “>”、“<”或“=”)。
状态;c10.08 (填 “>”、“<”或“=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是(填序号,下同),表中5min~6min之间数值发生变化,可能的原因是。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气的浓度
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,随后,他向烧杯中加入了一定量的溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn + CuSO4== Cu + ZnSO4设计成的锌铜原电池。Cu极的电极反应式是,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向移动(填“甲”或“乙”)。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是(填“CH4”或“O2”),a处电极上发生的电极反应式是;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为L。
(3)反应一段时间后,燃料电池的电解质溶液完全转化为K2CO3溶液,以下关系正确的是。
| A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(K+)>c(CO32-)>c(H+)>c(OH-) |
| D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-) |
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化 合价代数和等于6 合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是,Z元素在周期表中的位置是 。
。
(2)X、Y、Z三元素的最高价氧化物的水化物酸 性由强到弱的顺序是。
性由强到弱的顺序是。
(3)常温时,W的硫酸盐溶液的pH7(填“=”、“>”或“<”),理由是:(用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式。
有一包白色固体,可能是NaCl、K2CO3、Na2SO4和BaCl2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀完全溶解,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)通过上述实验现象分析:该白色固体中一定含有的物质为_______,不可能含有的物质为_______。
(2)试写出有关反应的离子方程式:
①______________________________;②______________________________;
③_________ _____________________。
_____________________。
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。B组:_________________________________。