(1)某反应过程中的能量变化如图所示: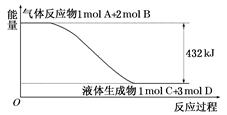
写出该反应的热化学方程式: 。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为 。
[化学—选修3:物质结构与性质]已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子,B的基态原子中有6种不同运动状态的电子,C原子核外成对电子数比未成对电子数多1,其氢化物常用作制冷剂,D原子中有2个未成对电子,E基态原子在同周期中原子半径最大,F原子价电子排布为nsn-1nPn+1 ,G基态原子核外所有轨道都处于全满状态且属ds区的元素。
(1)G基态原子价电子排布式 ;
(2)B、C、D基态原子第一电离能由大到小的顺序 ;
(3)离子化合物CA5的晶体中含有的化学键有 ;
A.离子键
B.极性键
C.非极性键
D.配位键
E.金属键
(4)E2D的熔点比E2F的熔点 (填“高”或“低”),原因是 ;
(5)与BD2互为等电子体的分子有 (要求写一种)
(6)GF在荧光体、光导体材料、涂料、颜料等行业中应用广泛。GF晶体结构如图所示,其晶胞边长为x pm,该晶体的密度为 g·cm-3(列式表示),a、b位置两粒子之间的距离为 pm(列式表示)(已知阿伏伽德罗常数为NA)
(15分)开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l)ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0
CO(g)+3H2(g)ΔH>0
①该反应的平衡常数表达式K= ,一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”“>”或“=”下同),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3v正(CH4)=v逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。当有4mol电子通过导线时,消耗标准状况下的O2体积为 L ,此时电解质溶液的PH值 (填“变大”、“变小”或“不变”)
(14分)亚硝酸是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化为Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白中含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。说明维生素C具有 性,亚硝酸盐具有 性(填“氧化”或“还原”)
(2)NaNO2和NaCl外观相似,肉眼不易分辨。下列方法中,不能用来区分NaNO2和NaCl的是 。
| A.分别测定这两种溶液的pH值 |
| B.酸性条件下分别将两种溶液加热 |
| C.在酸性条件下分别加入KI-淀粉溶液 |
| D.分别向两种溶液中滴加AgNO3溶液 |
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出该反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,是理想的水处理剂,其与水反应生成O2、Fe(OH)3(胶体)和KOH。
① KOH的电子式
② O2的结构式
③ K2FeO4中Fe的化合价为
④上述反应的离子方程式
汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)已知:N2(g) + O2(g) 2NO(g)ΔH1
2NO(g)ΔH1
N2(g) + 3H2(g) 2NH3(g)ΔH2
2NH3(g)ΔH2
2H2(g) + O2(g) 2H2O(g) ΔH3
2H2O(g) ΔH3
则4NO(g) + 4NH3(g) + O2(g) 4N2(g) + 6H2O(g)ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
4N2(g) + 6H2O(g)ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
(2)在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
| A.NO的生成速率与NO的消耗速率相等 |
| B.v(CO)=v(CO2) |
| C.体系的压强保持不变 |
| D.各物质的浓度保持不变 |
(3)可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:
C(s) + 2NO(g) N2(g) + CO2(g)ΔH >0
N2(g) + CO2(g)ΔH >0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
0.100 |
0 |
0 |
||
| 10 |
0.058 |
0.021 |
0.021 |
||
| 20 |
0.040 |
0.030 |
0.030 |
||
| 30 |
0.040 |
0.030 |
0.030 |
||
| 40 |
0.032 |
0.034 |
0.017 |
①写出该反应的平衡常数表达式:K= 。
②30 min后,改变某一条件,平衡发生了移动,则改变的条件是 ;
若升高温度,NO浓度将 (填“增大”、“不变”或“减小”)。
(8 分)将一定质量的铁粉加入到装有 100 mL 某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中的溶质的化学式为 。
②原硝酸溶液的物质的量浓度为 。
(2)向上述固液混合物中逐渐滴加稀硫酸直至刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式为 。
②(m-n)的值为 (精确到0.1 g)。