二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下: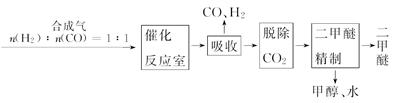
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) 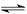 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g) 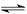 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) 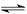 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+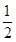 O2(g)
O2(g) 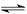 CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) 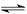 CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是 极。
两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。有下列组合的混合烃:
①C2H4和C3H4②CH4和C2H6③CH4和C4H4④C2H2和C3H6
其中不符合上述要求的是
| A.只有② | B.只有②④ | C.只有②③④ | D.只有①③ |
下列反应中,属于加成反应的是
| A.将苯滴入溴水中,振荡后水层接近无色 | B.乙烯使酸性KMnO4溶液褪色 |
| C.甲烷与氯气混合,光照后黄绿色变浅 | D.乙烯使溴水褪色 |
砹(At)是原子序数最大的卤族元素,推测砹及砹的化合物最不可能具有的性质是
| A.砹是有色固体 | B.HAt很稳定 |
| C.砹较易溶于有机溶剂 | D.AgAt不溶于水 |
元素A的阳离子与元素B的阴离子具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子半径:A<B ②原子序数:A>B③原子最外层电子数:B>A
④元素所在的周期数:A>B⑤A的最高正价与B的最低负价的绝对值相等
A、①② B、②③④ C、④⑤ D、②⑤
日本的白川英树、美国的马克迪尔米德和艾伦·黑格尔,由于发现了掺杂聚乙炔具有良好导电性而共同获得2000年诺贝尔化学奖。以下关于聚乙炔的叙述错误的是
| A.单体为不饱和烃 | B.聚乙炔的分子中含有碳碳双键 |
| C.聚乙炔的相对分子量为26 | D.聚乙炔可用于生产导电橡胶 |