反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是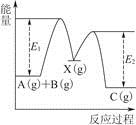
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
下列物质的电子式书写正确的是
A. |
B. |
C. |
D. |
下列物质中,只含有离子键的是
| A.NaOH | B.NH 4Cl | C.MgCl2 | D.H2O |
X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
| A.原子序数X<Y | B.原子半径X<Y |
| C.离子半径X>Y | D.原子最外层电子数X<Y |
应用元素周期律分析下列推断,其中正确的组合是
①卤素单质的熔点随原子序数的增大而升高
②砹(85At)是VIIA族,其氢化物的稳定性大于HC1
③硒(34Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(81Tl)与铝同主族,其单质既能与盐酸反应又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
| A.①③④ | B.①③⑥ | C.③④⑤ | D.②④⑥ |
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |