甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断,ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是:()
| A.两种气体的压强相等 | B.两种气体的质量之比为3:2 |
| C.两种气体的分子数目相等 | D.两种气体所含质子数目相等 |
配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是()
| A.未冷却即转移、定容 |
| B.容量瓶中原有少量蒸馏水 |
| C.定容时俯视刻度线 |
| D.摇匀后溶液倒入试剂瓶时,试剂瓶中原有少量水 |
能用H++OH-=H2O来表示的化学反应是()
| A.Ba(OH)2溶液滴入稀硫酸中 | B.澄清石灰水和稀硝酸反应 |
| C.氢氧化镁和稀盐酸反应 | D.氢氧化钠和醋酸反应 |
下列说法中不正确的是:()
①将硫酸钡放入水中不能导电,所以硫酸钡是非电解质;②氨溶于水得到的溶液氨水能导电,所以氨水是电解质;③固态的冰醋酸不导电,液态的纯醋酸可以导电;④NaHSO4电离时生成的阳离子有氢离子,所以是酸;⑤电解质放在水中一定能导电. 非电解质放在水中一定不导电。
| A.①②③ | B.①②③④⑤ | C.①③④ | D.①②④⑤ |
下列电离方程式书写正确的是()
A.Na3PO4=3Na++ |
B.Ba(OH)2=Ba2++ |
| C.CH3COOH=CH3COO-+H+ | D.NaHCO3=Na++H++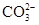 |