已知:
①I2(g)+H2(g)  2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)  2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.I2(g)===I2(s) ΔH=-17.00 kJ/mol |
| C.固态碘的稳定性比气态碘的稳定性高 |
| D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多 |
在容积不变的密闭容器中,一定条件下发生反应:2A B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )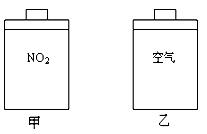
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.物质A一定为非气态,且正反应是吸热反应 |
| D.若向容器中充入惰性气体,则平衡向右移动 |
密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 25℃时初始浓度/mo1·L-1 |
0.1 |
0.2 |
0 |
| 25℃时平衡浓度/mo1·L-1 |
0.05 |
0.05 |
0.1 |
| 50℃时平衡浓度/mo1·L-1 |
0.06 |
0.08 |
0.08 |
下列说法错误的是 ( )
A.该反应是放热反应 |
B.该反应可表示为X+3Y 2Z |
| C.增大压强使平衡向生成Z的方向移动,X浓度减小 | |
| D.反应达到平衡时,Y的分解速率是Z的分解速率的1.5倍 |
CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是 ( )
①铜片做阴极,石墨做阳极 ②铜片做阳极,石墨做阴极
③阳极有氧气生成 ④阴极有氢气生成
⑤白色沉淀在阳极附近生成 ⑥白色沉淀在阴极附近生成
⑦阳极区溶液变蓝的原因是2Cu+4I――4e-=2CuI↓+I2碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH――4e―=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝
| A.只有②④⑤⑦ | B.只有①④⑥⑦ | C.只有②③⑤⑧ | D.只有①③⑥⑧ |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH值变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲 = V乙 |
| D.电极反应式:甲中阴极:Cu2++2e- |
乙中负极:Mg-2e-Mg2+
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是( )
A.负极发生的反应为:Fe-3e- = Fe3+  |
B.正极发生的反应为:2H2O+O2+2e- = 4OH- |
| C.原电池是将电能转变为化学能的装置 | |
D.钢柱在空气与水 交界处比在水下部分更容易腐蚀 交界处比在水下部分更容易腐蚀 |