A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是 ,C2B2的电子式为 。
(2)B、C、D、F的离子半径由大到小的顺序是 (用离子符号表示)。
(3)E和F相比,非金属性强的是 (用元素符号表示),下列事实能证明这一结论的是 (用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为 (填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为 。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为 ,pH=10的乙溶液中由水电离产生的c(OH-)= mol·L-1。
(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式: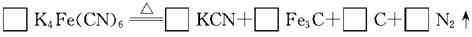
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol。
水是生命之源,也是化学反应中的主角。请回答下列问题:(下列问题
所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
。
Ⅱ.有以下五组离子① K+、Cl-、NO3-、S2-;② K+、Fe2+、I-、SO42-;③ Na+、Cl-、
NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-;⑤ K+、Ba2+、Cl-、NO3-。在由水电离产生的
c(OHˉ)= 1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是 (填序号)
Ⅲ.在许多反应中H2O扮演不同的“角色”。请结合所学完成下列反应
(1)H2O参与的置换反应:符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水,离子方程式为;
②V是水,化学方程式为。
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O;
②B + H2O;
咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
(1)咖啡酸的化学式是,咖啡酸中含氧官能团的名称为。
(2)咖啡酸发生加聚反应的化学方程式。
(3)下列关于咖啡酸的说法正确的是()
| A.1mol咖啡酸只与1mol溴反应 |
| B.咖啡酸有一种同分异构体的苯环上连4个羟基 |
| C.咖啡酸的水溶液中滴加氯化铁溶液显血红色 |
| D.可以用高锰酸钾或溴水检验咖啡酸分子中所含的碳碳双键 |
(4)写出1分子咖啡酸与2分子CH3COCl在一定条件下发生反应生成酯的方程式。
(5)A是咖啡酸的一种同分异构体,A中苯环上的取代基仅1个,1molA能与2molNaHCO3反应,A的结构简式为。
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如下: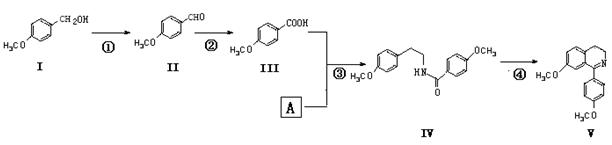
(1)化合物Ⅱ的化学式为,所含官能团的名称为____________________。
(2)反应①的化学方程式为(不要求写出反应条件)。
(3)化合物A的结构简式为。
(4)下列说法正确的是__________。
| A.化合物Ⅱ能与4 molH2发生加成反应 |
| B.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气 |
| C.化合物Ⅰ~Ⅴ均属于芳香烃 |
| D.化合物Ⅱ能发生银镜反应 |
(5)化合物VI与化合物Ⅲ互为同分异构体,VI中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的VI的结构简式:。
(6)化合物Ⅶ(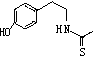 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
有机物A由碳、氢两种元素组成。现取0.2molA与一定量的氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应没有剩余)。将反应生成的气体依次通过浓硫酸、碱石灰和灼热的氧化铜,浓硫酸增重18g,碱石灰增重26.4g,氧化铜质量减少3.2g。
(1)通过计算确定该有机物的分子式;
(2)写出符合上述条件的有机物的结构简式。