有Fe2+、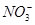 、Fe3+、
、Fe3+、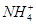 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
C.每1 mol 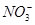 发生氧化反应,转移8 mol e- 发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是( )
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS |
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A,1 mol B,发生反应:2A(g)+B 3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
3C(g) ΔH=-Q kJ/mol(Q>0)。经过60 s达到平衡,测得B的物质的量为0.2 mol,下列对该平衡的叙述正确的是( )
| A.用C的浓度变化表示该反应速率为2.4 mol/(L·min) |
| B.若使容器变为1 L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
控制适宜条件,将反应Sn(s)+Pb2+ (aq) Sn2+ (aq)+Pb(s)△H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s)△H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )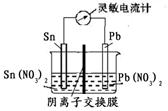
| A.此时化学反应达到平衡状态 |
| B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
下列各组离子在指定条件下,能够大量共存的是( )
| A.滴加KSCN溶液后变成血红色的溶液中:K+、SO42―、Mg2+、H+ |
| B.由水电离出的c(H+)=1×10-11mol/L的无色溶液中:Al3+、Cu2+、NO3―、SO42― |
| C.能使淀粉KI试纸变蓝的无色溶液中:Na+、S2―、K+、Br― |
| D.能使蓝色石蕊试纸变红的溶液中:K+、Na+、AlO2―、HCO3― |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |