已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式: 。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是 。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为 mol。
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:___________。
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行。
(4)所含元素超过18种的周期是第、周期
(5)请写出298K,101KPa时,下列反应的热化学方程式:
用CO(g)还原1mol Fe2O3(s)放热24.8KJ 。
(本题共14分)碱金属元素按原子序数增大,依次为:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr,放射性元素)。请回答:
52.常温常压下,将一定量锂单质投入到一定量重水中,锂完全反应,产生1.6g气体,过滤得到6.75g沉淀和100mL澄清溶液。则得到的澄清溶液中溶质的物质的量浓度为。
53.钠钾合金许多特殊反应中有着非常重要的应用。取59.80g钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出5.40g纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为。
54.某同学在实验室模拟制备纯碱。0.600 mol NH3和35.100g食盐混合,得到氨盐水总质量为105.300 g。向该溶液通入CO2至反应完全,过滤,得到滤液88.200g,则NaHCO3的产率为______________。(保留三位小数)
55.一定条件下,85.5g铷与氧气和臭氧的混合气体22.4L(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物A和B的固体混合物。A和B中,阴阳离子个数比均为1:1且均存在两种微粒间作用力,A的含氧量为0.3596。则化合物A的化学式为。
将上述固体混合物加热,A可分解生成B和氧气。加热一段时间后,固体混合物中两种阴离子的物质的量相等,则分解产生的氧气在标况下的体积为。
(本题共12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。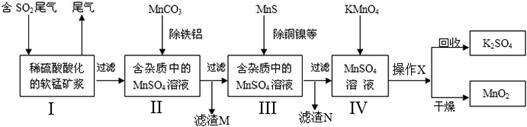
请回答下列问题:
38.上述流程脱硫实现了(选填编号)。
a.废弃物的综合利用b.白色污染的减少
c.酸雨的减少d.臭氧层空洞的减少
39.步骤I生成无水MnSO4的化学方程式是。
步骤IV生成无水MnO2的化学方程式是。
40.步骤I中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是。滤渣M的成分是。铜元素以形式存在于滤渣N中。(写化学式)
41.产品MnO2可作超级电容材料。用惰性电极电解MnSO4溶液可以制得MnO2,则MnO2在生成(填电极名称)。
42.假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将2.0 m3(标准状况)含SO2的体积分数为60%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量10.44 kg。则在除去铁、铝、铜、镍等杂质的过程中,所引入的锰元素为kg。
(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系:。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较):。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理:。
H++HPO42—,请根据该平衡体系分析其缓冲原理:。
(本题共12分)目前,碳族元素按原子序数增大,依次为:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)。请回答:
23.锗原子的最外层电子排布式:,锡原子的最外层电子云有种伸展方向; 单质锗具有__________(填字母)。
a.只有金属性
b.只有非金属性
c.既有金属性,又有非金属性
24.某同学根据反应:SiO2 + 2C Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:。
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:。
25.常温下,在400mL稀氢氟酸中,投入一颗石英玻璃,2.5min后,溶液质量减少了11.22g。此时SiF4为气体,则这段时间内用HF表示该反应的平均化学反应速率为。
高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO。回答26-27题:
26.下列选项中,一定符合反应达到化学平衡时情况的选项是。
a.压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大
b.速率关系:2v(CO2)= v(CO)
c.转移电子数随温度升高而增多
d.气体密度随着焦炭的增加而增大
27.达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是(填选项编号)。
A.CO2和CO浓度比b.混合气体的密度
c.转化率d.CO的体积分数