工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: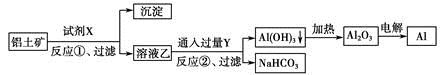
下列叙述正确的是
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
设NA代表阿伏加德罗常数的值,下列说法不正确的是
| A.阿伏加德罗常数NA的数值是0.012kg12 C 中所含的原子数 |
| B.标准状况下,22.4LCl2与过量Fe反应时转移电子数目为2NA |
| C.标况下,22.4L SO2所含的分子数目约为NA |
| D.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA |
下列物质中,不属于电解质的是( )。
| A.NaOH | B.H2S04 | C.蔗糖 | D.NaCl |
现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B,49g C,还有D生成。已知D的式量为106。现将22gA和11gB反应,生成D的物质的量为 ( )
A. 1mol B. 0.5mol C. 0.275mol D. 0.25mol
下列叙述正确的是()
| A.一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子大小决定 |
| B.一定温度和压强下,各种气态物质所占体积的大小,由构成气体的分子数决定 |
| C.不同的气体,若体积不同,则它们所含的分子数也不同 |
| D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为()
| A.加入过量的Na2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 |
| B.加入过量的K2SO4溶液,过滤除去沉淀,所得溶液中补加适量HNO3 |
| C.加入过量的Na2SO4溶液,过滤除去沉淀,所得溶液中补加适量HNO3 |
| D.加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 |