欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。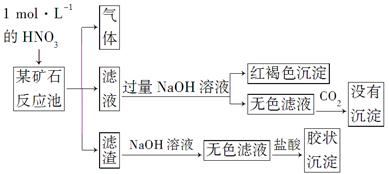
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
卤族元素随着原子序数的增大,下列递变规律正确的是
| A.单质熔、沸点逐渐降低 | B.原子半径逐渐增大 |
| C.单质的氧化性逐渐增强 | D.气态氢化物稳定性逐渐增强 |
下列元素中,金属性最强的是
| A.锂 | B.钠 | C.钾 | D.铷 |
下列元素中,原子半径最大的是
| A.Li | B.Na | C.F | D.Cl |
下列关于能源和作为能源物质的叙述中错误的是
| A.燃料燃烧时将化学能全部转化为热能 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能为人类所利用 |
| D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
原子核裂变反应放出的能量是一种高效的优质能源。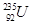 原子常用于核裂变反应,下列对其描述正确的是
原子常用于核裂变反应,下列对其描述正确的是
| A.中子数92 | B.电子数143 |
| C.核电荷数235 | D.中子数与质子数之差51 |