(2008·信宜)根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各微粒的电子总数相同,则互称为等电子体。以下各组微粒不是等电子体的是( )
| A.CO和N2 | B.O3和NO2- | C.N2H4和C2H4 | D.CO2和 N2O |
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生物体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号: B_____________ D____________ E___________。
(2)写出B、D两元素组成的非极性分子的电子式___________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_______________________________、________________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:_________________________________________。
(2008·武汉)下列各组物质中,将前者加入后者时,无论前者过量与否,都能用同一个化学方程式表示的是()
| A.澄清石灰水,CO2 | B.氢氧化钠溶液,AlCl3溶液 |
| C.Fe ,Cl2 | D.稀硫酸溶液,NaAlO2溶液 |
下列化学用语表达正确的是()
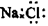 |
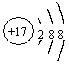
| A.S2-的结构示意图: | B.NaCl的电子式: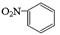 |
| C.乙炔的结构简式CHCH | D.硝基苯的结构简式: |
只含有一种元素的物质()
| A.可能是纯净物也可能是混合物 | B.可能是单质也可能是化合物 |
| C.一定是纯净物 | D.一定是一种单质 |