已知:CH3—CH=CH2+HBr→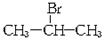 (主要产物),1 mol某芳香烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
(主要产物),1 mol某芳香烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。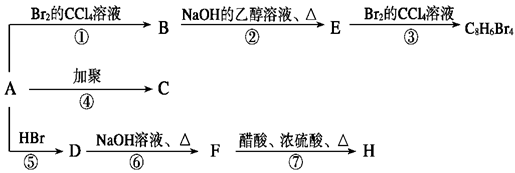
(1)A的结构简式: 。
(2)上述反应中,①是 反应,⑦是 反应。(填反应类型)
(3)写出C,E物质的结构简式:C , E ,
(4)写出D→F反应的化学方程式 。
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据右图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据右图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是。
A体系的密度不发生变化B SO2与SO3的体积比保持不变
C体系中硫元素的质量百分含量不再变化D单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。 图1 图2图3
图1 图2图3
①该反应的平衡常数表达式为,升高温度,平衡常数(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为(填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈性,所得溶液中c(H+)- c(OH-)=(填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
(14分)尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为_______,雷电作用能进行氮的固定,写出反应方程式______________。
(2)食物蕴含的营养物质中,含氮的高分子化合物是______________ (填名称),其水解的最终产物为______________。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: ______________。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式).______________。②若沉淀质量为7.8g,则合金的质量为______________g。
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。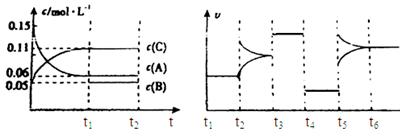
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)=mol/(L∙s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为mol;
(4)t1时刻,平衡常数K=;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式;
(6)若t2时刻后图像变化如下图,则改变条件为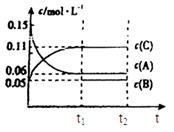
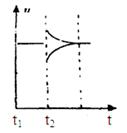
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是(填“图1”或“图2”)
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系,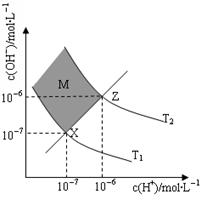
①M区域内(阴影部分)任意点c(H+)______c(OH-)
(填“大于”、“小于”或“等于”)
②在T2温度下,将PH=9 NaOH溶液与PH=4 HCl溶液混合,
若所得混合溶液的 PH=7,则NaOH溶液与HCl溶液
的体积比为。(混合后溶液体积的变化忽略不计)
I.现将反应2Fe3+ + 2I- 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池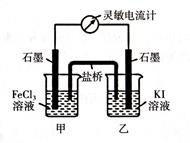
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零 b.电流计指针不再偏转且不为零 c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。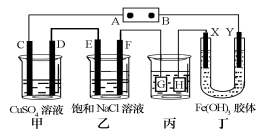
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。