H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
| A.滴加新制氯水,溶液pH减小 | B.通入过量SO2气体,溶液pH增大 |
| C.加水,溶液中氢离子浓度增大 | D.加入少量硫酸铜固体,所有离子浓度都减小 |
下列关于葡萄糖与果糖的说法不正确的是( )
| A.两者互为同分异构体 |
| B.两者都易溶于水 |
| C.两者都能发生银镜反应 |
| D.葡萄糖比果糖甜 |
A、B两瓶液体,一瓶是植物油,一瓶是矿物油。现各取少量,放在两支洁净的试管里,加入NaOH溶液并加热,冷却后加水振荡静置,A出现泡沫,B无泡沫且分为两层。
由此可推出,A为________,B为________。
理由是___________________________________________。
天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意图中的反应式不完整)。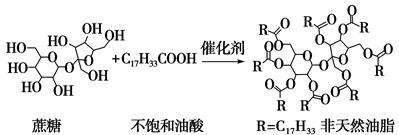
下列说法正确的是( )
| A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质 |
| B.该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 |
| C.非天然油脂为高分子化合物 |
| D.该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物 |
某物质的结构为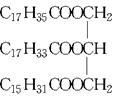 ,关于该物质的叙述正确的是( )
,关于该物质的叙述正确的是( )
| A.一定条件下与氢气反应可以生成硬脂酸甘油酯 |
| B.一定条件下与氢气反应可以生成软脂酸甘油酯 |
| C.与氢氧化钠溶液混合加热能得到肥皂的主要成分 |
| D.与其互为同分异构体且完全水解后产物相同的油脂有三种 |
某种饱和脂肪酸的甘油酯22.25 g,完成皂化反应时需3.00 g氢氧化钠,则这种高级脂肪酸中的碳原子数接近的数值是( )
| A.15 | B.16 | C.17 | D.18 |