一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g) C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
| 容器编号 |
n(B)/mol |
n(C)/mol |
n(D)/mol |
反应时间/min |
反应速率 |
| Ⅰ |
0.06 |
0.60 |
0.10 |
t1 |
v(正)=v(逆) |
| Ⅱ |
0.12 |
1.20 |
0.20 |
t2 |
|
| Ⅲ |
0.32 |
1.0 |
0 |
0 |
|
| Ⅳ |
0.12 |
0.30 |
|
|
v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是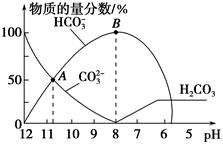
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)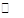 2SO3(g);
2SO3(g);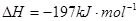 。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
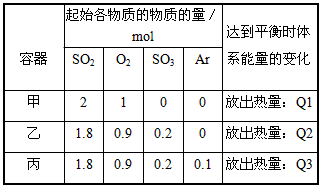
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
B.Q1=Q2=Q3="197" kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
常温下0.1mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
| A.将溶液稀释到原体积的10倍 | B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 | D.提高溶液的温度 |
将100mL1 mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中碳酸根离子浓度的变化分别是
| A.减小、减小 | B.减小、增大 | C.增大、增大 | D.增大、减小 |