在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
如果25 ℃时,Kw=1.0×10-14,某温度下Kw=1.0×10-12。这说明
| A.某温度下的电离常数较大 |
| B.前者的c(H+)较后者大 |
| C.水的电离过程是一个放热过程 |
| D.Kw和K电离无直接关系 |
在醋酸中存在电离平衡:CH3COOH CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
| A.加入NaOH(s) | B.加入盐酸 |
| C.加蒸馏水 | D.升高温度 |
在醋酸溶液中,CH3COOH的电离达到平衡的标志是
| A.溶液显电中性 |
| B.溶液中无醋酸分子 |
| C.氢离子浓度恒定不变 |
| D.溶液中CH3COOH和CH3COO-共存 |
下列叙述中,能证明某物质是弱电解质的是
| A.熔融时不导电 |
| B.水溶液的导电能力很差 |
| C.不是离子化合物,而是极性共价化合物 |
| D.溶液中已电离的离子和未电离的分子共存 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: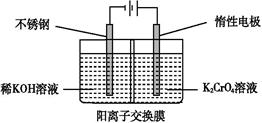
下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e- 2OH-+H2↑ 2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动 Cr2O72-+H2O向右移动 |
C.该制备过程中总反应的化学方程式为4K2CrO4+4H2O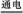 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-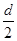 |