苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g)+ C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
某化学兴趣小组研究双氧水的分解时,设计了以下三组实验,每一小组取若干支试管分别加入相同体积5%的双氧水,在实验室观察气泡产生的情况。
(1)双氧水发生分解的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)根据下表中实验操作及实验现象填写实验结论:
| 组别 |
操作 |
现象 |
实验结论 |
| 第一组 |
①向试管中加0.2 g MnO2粉末并置于盛有5 ℃水的烧杯中 |
少量气泡 |
|
| ②向试管中加0.2 g MnO2粉末并置于盛有50 ℃水的烧杯中 |
大量气泡 |
||
| 第二组 |
③向试管中加0.2 g MnO2粉末 |
大量气泡 |
|
| ④向试管中的液体中加蒸馏水稀释10倍后加0.2 g MnO2粉末 |
少量气泡 |
||
| 第三组 |
⑤向试管中加0.2 g MnO2粉末 |
大量气泡 |
|
| ⑥向试管中加5滴 FeCl3溶液 |
大量气泡 |
一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol·L-1。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(1)容器中气体出现红棕色的原因是(用化学方程式表示)
________________________________________________________________________。
(2)前2 s内,乙容器中以N2O4的浓度变化表示的平均反应速率为____________________。
(3)达到平衡时,甲容器中反应所需的时间______60 s(填“大于”、“小于”或“等于”,下同);两容器中都达到平衡时,N2O4的浓度:甲__________乙,反应过程中吸收的能量:甲__________乙。
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是__________。
| A.保持温度不变,适当压缩甲容器 |
| B.保持容器体积不变,使甲容器升温 |
| C.保持容器体积和温度不变,向甲容器中加入适量N2O4 |
| D.保持容器体积不变,使甲容器降温 |
以化学平衡移动原理为依据,解释以下事实。
(1)在氨水中加入氢氧化钠溶液,有氨气逸出
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)合成氨工业中将氨气液化,可以提高氨的产量
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)用热水溶解碳酸钠晶体(Na2CO3·10H2O),可提高去污能力
________________________________________________________________________
________________________________________________________________________。
(4)打开冰冻啤酒倒入玻璃杯,杯中立即泛起大量泡沫
________________________________________________________________________
________________________________________________________________________。
在密闭容器中进行下列反应CO2(g)+C(s) 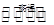 2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化。
2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C的用量,平衡__________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡____________,c(CO2)________。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡____________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡____________,c(CO2)________。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH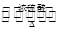 CH3COOC2H5+H2O。请根据要求回答下列问题:
CH3COOC2H5+H2O。请根据要求回答下列问题: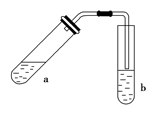
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是
________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
________________________________________________________________________。
(3)实验中加热试管a的目的是:①__________________;
②________________________________________________________________________。
(4)此反应以浓硫酸为催化剂,可能会造成____________、____________________等问题。
(5)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率/% |
选择性/% |
反应时间/h |
转化率/% |
选择性/% |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.8 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
| 选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为
________________________________________________________________________。