氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
1985年,科学家发现C60分子是由60个碳原子构成的,它的形状像足球(图C),因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,它是由六边环形的碳原子构成的管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
试回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管物理性质存在较大差异的原因是 。
(2)常温下足球烯和碳纳米管的化学性质是否比金刚石和石墨活泼?____________(填“活泼”和“一样”)理由是 。
(3)由下边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为 。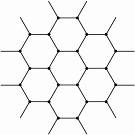
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有_____(填数字)个碳原子,每个碳原子上的任两个C—C键的键角都是 (填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决制得H2后的贮存问题,在上述四种碳单质中有可能成为贮氢材料的是 。
A、B、C、D是按原子序数由小到大排列的第2、3周期的元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):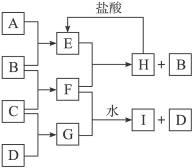
请填写下列空白:
(1)A是______________________,C是______________________。
(2)H与盐酸反应生成E的化学方程式是______________________________________。
(3)E与F反应的化学方程式是______________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是____________________________。
在右图中填上元素周期表中与硅上下相邻、左右相邻的元素符号,并完成下列问题:
(1)其中最高价氧化物对应的水化物酸性最强的元素是_________,酸的化学式为______________。
(2)硅酸的酸性比_____________、_____________强,比_____________、____________弱。
在电弧作用下使石墨蒸发,在真空中冷凝,得到空心球状分子,其相对分子质量分别为720和840,写出这两种分子的化学式:____________和___________。它们与石墨的关系是_____________;其中一种分子可与金属钾形成超导化合物,该物质的相对分子质量为837,则此化合物的化学式为______________。
有A、B、C三种非金属元素,A原子与B原子的核外电子总数恰好等于C原子的一半,B原子与C原子的最外层电子数相同,它们各自的质子数与中子数均相等,1 mol C溶于苛性钠溶液中产生2 mol气体。
(1)它们的名称分别是:A_____________,B_____________,C_____________。
(2)写出1 mol C溶于苛性钠溶液中产生2 mol气体的化学反应方程式:_________________。
(3)B、C的最高价氧化物对应水化物中酸性较强的是_________________(写酸的化学式),在自然界中能稳定存在的A的同位素原子名称为__________________________。
(4)C的氧化物与B反应生成C单质的化学反应方程式为____________________________,C的氧化物与纯碱在一定条件下反应的化学方程式为________________________________。