将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是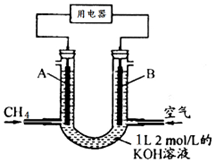
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
① 0.25molNa2O2中含有的阴离子数为0.5 NA
②0.05 mol熔融的KHSO4中含有阳离子数目为0.10 NA
③ 1mol α-氨基乙酸(甘氨酸)分子中存在10NA对共用电子
④ 1mol/L的Na2CO3溶液中含有CO32-一定小于NA⑤ 标准状况下,2.24L CHCl3含有的分子数为0.1 NA
⑥电解精炼铜时,当阳极溶解32 g铜时,转移的电子数为NA个
⑦ 2mol的Zn与足量的浓硫酸反应转移的电子数为4NA
| A.2个 | B.3个 | C.4个 | D.5个 |
若以M表示水的摩尔质量,V表示在标准状况下水蒸气的摩尔体积,ρ为在标准状况下的密度,NA为阿伏加德罗常数,m、Vx分别表示每个水分子的质量和体积,下面是四个关系式:①NA=Vρ/m,②ρ=M/(NAVx),③ m=M/NA,④Vx=V/NA,其中
| A.①②是正确的 | B.①③是正确的 |
| C.①③④是正确的 | D.①②③④都正确 |
下列描述,其因果关系成立的是
| A.因为NH3的水溶液可以导电,所以NH3是电解质 |
| B.因为SO2可以使溴水褪色,所以SO2具有漂白性 |
| C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D.因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应 |
通过复习总结,你认为下列对化学知识概括合理的是
| A.金属氧化物都是强电解质 |
| B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C.在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
| D.能与金属镁反应产生氢气的溶液一定是酸溶液 |
化学已渗透到人类生活的各个方面。下列说法正确的是
| A.光导纤维导电能力很强,是一种很好的通讯材料 |
| B.氢氧燃料电池、纽扣电池、硅太阳能电池都利用了原电池原理 |
C.在入海口的钢铁闸 门上装一定数量的铜块可防止闸门被腐蚀 门上装一定数量的铜块可防止闸门被腐蚀 |
D.禁止使用四乙基铅作汽油抗爆震剂,可减少 汽车尾气污染 汽车尾气污染 |