某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是 ;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是 ;
关于M中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中 = 。
= 。
某实验小组用下列装置进行乙醇催化氧化的实验。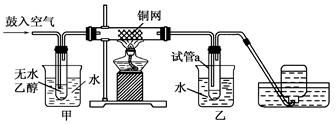
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_________________、___________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴的作用不相同。甲的作用是________;乙的作用是___________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是__________。集气瓶中收集到的气体的主要成分是________。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好实验装置,关闭活塞a、b、c,在铜网的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体。在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式为 ;
B的作用是,C中热水的作用是_____________
(2)从M管中可观察到的现象是,请写出相应的化学反应方程式:_____________
(3)实验进行一段时间后,如果撤掉酒精灯,反应能继续进行,其原因是_________________。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: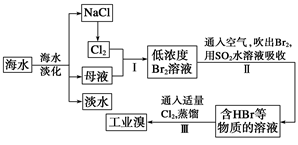
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是: _________________。
(3)兰州一中某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图: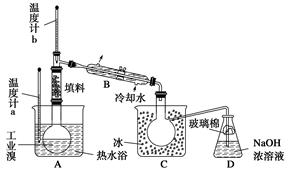
请你参与分析讨论:
①图中仪器B的名称是__________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? ____________________。
(14分)以下四组装置在下列实验可供选择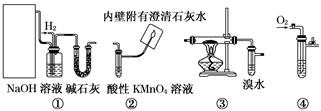
Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:
(1)应选择的装置是___ _____(填写编号)。
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式___________________
(3)实验结束后,观察到溴水褪色。为解释这一现象,某学习小组的同学提出两种猜想:
A. 发生了加成反应; B. 发生了氧化反应。
为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH,测得溶液的pH下降,你认为发生何种反应,请说出你的理由________________。
Ⅱ.若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式_______________________________________。
(5)NaOH溶液的作用是(答两点即可)____________、_。
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因______________;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷 _____________________________________。
(14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高
(1)组装好上述装置后,首先要进行的操作是:。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是、;B中加入的试剂和作用是、。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:。