常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+ |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是:
| A.x=1 |
| B.A的平均反应速率为0.2mol/(L·s) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
关于下列装置说法正确的是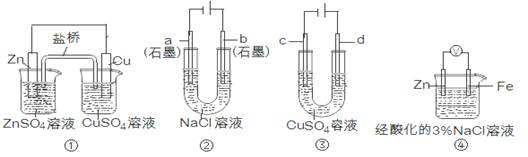
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
下列实验能达到预期目的的是
| 序号 |
实验操作 |
实验目的 |
| A |
向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 |
说明汽油中含有甲苯等苯的同系物 |
| B |
将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 |
CH3CH2Br未发生水解 |
| C |
pH均为1的盐酸、醋酸溶液分别用蒸馏水稀释m倍、 n倍后的pH相同 |
m<n |
| D |
蔗糖溶液中加入少量稀硫酸、加热,然后加银氨溶液再加热 |
验证蔗糖在强酸性条件下是否发生水解 |
下列离子方程式表达正确的是
| A.在漂白粉配制成的溶液中通入SO2: Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO |
| B.四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C.苯酚钠溶液与少量二氧化碳反应:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| D.等物质的量的溴化亚铁跟氯气反应:Fe2+ +2Br-+ C12===Fe3+ + Br2 +2Cl- |
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,下列说法中正确的是
| A.食盐中由于含适量的碘化钾因而可有效地抗核辐射 |
| B.可用淀粉溶液检验碘盐中是否含碘元素 |
| C.23Na37Cl中质子数和中子数之比是8∶7 |
| D.福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |