二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
| 物质 |
A |
B |
CO |
H2 |
| 燃烧热/kJ·mol-1 |
725 |
5518 |
283 |
286 |
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
(1)A、B的相对分子质量为A________,B_______。
(2)等物质的量的A、B混合的燃料73g,在160LO2中完全燃烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体积均在标准状况下测定)。由此可推得混合物中N(C)∶N(H)∶N(O)=_____________________,A分子式为__________________,B分子式为__________________。
(3)1mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO________ mol。
在有机分析中,常用臭氧化分解来确定有机物中碳碳双键的位置与数目。如:(CH3)2C=CH-CH3 (CH3)2C=O+CH3CHO
(CH3)2C=O+CH3CHO
已知某有机物A经臭氧化分解后发生下列一系列的变化:
试回答下列问题:
(1)有机物A、F的结构简式为A: 、F: 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)写出下列变化的化学方程式。
①I水解生成E和H:;
②F制取G:。
某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子的连接方式可能会发生变化,A、B、C、D分子结构中都有4个甲基 ,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
|
(1)A的相对分子质量是_________
(2)A和D的结构简式分别是________________和______ _________________
_________________
现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
| ① |
He-268.8 |
Ne-249.5 |
Ar(x) |
Kr-151.7 |
| ② |
F2-187.0 |
Cl2-33.6 |
(a) 58.7 |
I2 184.0 |
| ③ |
HF(y) |
HCl-84.0 |
HBr-67.0 |
HI-35.3 |
| ④ |
H2O(z) |
H2S-60.2 |
(b)-42.0 |
H2Te-1.8 |
试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系 列其它物质反常,反常的主要原因是__
列其它物质反常,反常的主要原因是__
___________________________________________________________________________。
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题: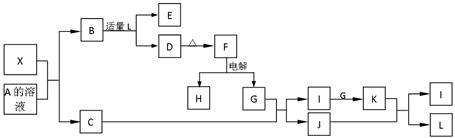
(1)写出X的化学式:__________,X属于__________ 晶体(填“原子”、“分子”或“离子”)。
晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)若B中加入足量的L,则不能生成D物质,请用离子方程式表示其原因:
。
(4)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。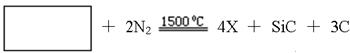 。
。