中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3 |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: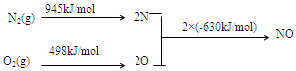
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。你的依据是 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: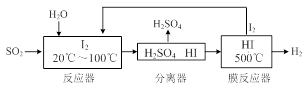
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于。
(6)①HClO4、②HIO4、③H5IO6 [可写成(HO)5IO] 的酸性由强到弱的顺序为(填序号)。
据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是。
(a)CO2 +CaO  CaCO3(b)K2CO3+CO2+H2O=2KHCO3
CaCO3(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是。
(a)用太阳能光解海水制氢(b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢(d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为:。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为:。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y=(用x表示)。
对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式;
(2)25℃时,反应2CO2 (g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3) 1600℃时,反应2CO(g)+O2(g)  2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为;
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式。
MMA既是一种高分子化合物(有机玻璃)的单体,又是制取甲基丙烯酸丙酯等的重要原料。现有三条制备高分子(MMA)的途径,其流程下如:
(1)工业上将A和甲醇及过量硫酸一起,一步反应生成MMA,该反应的化学方程式为
_________。
(2)反应②是在500℃并有催化剂存在的条件下发生的,则其反应类型为:。
(3)某物质既能发生银镜反应,又能发生水解反应,其分子中还有手性碳原子,并与 互为同分异构体,则其物质结构简式为:____。
互为同分异构体,则其物质结构简式为:____。
(4)物质D的核磁共振氢谱有两个峰,它与CO、CH3OH以物质的量之比1︰1︰1反应恰好生成MMA,则D的结构简式为__________,该方法的优点是______。
(5)MMA和1-丙醇反应制取甲基丙烯酸丙酯的化学方程式为:____________。
(6)根据题中流程里提供的新信息,写出由(CH3)2C=CH2制备化合物
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物。(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去) 。
请回答下列问题:
(1)L的电子式为_______________。
(2)J溶液蒸干灼烧得到的物质是(填化学式) _______________。
(3)反应①的化学方程式是____________________________________。
(4)反应②的离子方程式是____________________________________。
(5)Na2FeO4能起到消毒净水的原理是。(用文字叙述)