一定条件下存在反应:2SO2(g)+O2 (g) 2SO3(g) ∆H=−196kJ·moL−1。现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的
2SO3(g) ∆H=−196kJ·moL−1。现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的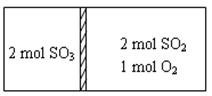
| A.恒温条件下,达到平衡容器两边SO3的体积分数相同 |
| B.恒温条件下,容器中两边的吸收或放出的热量数值之和小于为196kJ |
| C.若容器为绝热,达到平衡时右室反应速率等于左室反应速率 |
| D.若容器为绝热容器,右室中SO2的转化率与左室SO3的转化率之和小于1 |
下列有关物质性质的应用错误的是
| A.纯净的二氧化硅具有良好光学性能,可用于制作光导纤维 |
| B.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| C.BaCO3难溶于水,可用作胃透视检查时的钡餐 |
| D.NaHCO3受热易分解,可用作焙制糕点的膨松剂 |
有关化学用语正确的是
A.质子数27的钴-60原子: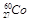 |
B.氯化铵的电子式: |
C.S2-的结构示意图: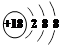 |
| D.Cl-的电子排布式:1s22s22p63s23p5 |
下列说法错误的是
| A.使用可降解塑料聚二氧化碳,能减少白色污染 |
| B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 |
| C.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D 的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为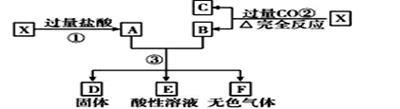
| A.4:1 | B.1:2 | C.2:1 | D.1:1 |
一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来的温度。下列叙述中不合理的是
| A.NaOH溶液浓度增大,并放出H2 |
| B.溶液中NaOH的质量分数不变,有H2放出 |
| C.溶液的质量减小,有H2放出 |
| D.钠浮于液面,到处游动,发出“嘶嘶”的响声 |