(15分)高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族。下面有关硅材料的说法中正确的是__________(填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料———光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰 |
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知: 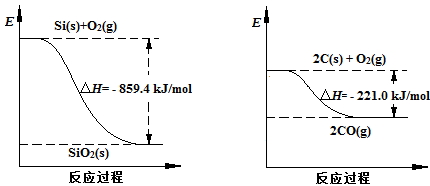
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) ="==" Si(s) + 2CO(g) △H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
| 物质 |
SiHCl3 |
SiCl4 |
AsCl3 |
| 沸点/℃ |
32.0 |
57.5 |
131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g) +H2(g)  Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。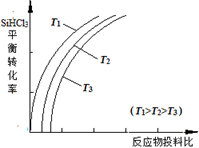
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是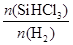
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:____________________。
烯丙醇是一种无色有刺激性气味的液体,是重要的有机合成原料,其结构简式为 CH2=CH—CH2OH。请回答:
(1)烯丙醇的分子式为;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气L。
(3)写出烯丙醇与溴水反应的化学方程式,反应类型为:_____________________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为 。
请完成下列两小题
(1)下面列出了几组物质,请选择合适物质的序号填在空格上。
同位素;同系物;同分异构体。
① 金刚石和石墨 ②CH3CH2CH2CH3和(CH3)2CHCH3
③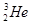 和
和 ④CH3CH3和CH3CH2CH2CH3
④CH3CH3和CH3CH2CH2CH3 ⑤⑥CH2=CHCH3和CH2=CH2;
⑤⑥CH2=CHCH3和CH2=CH2;
⑦D与T ⑧甲酸乙酯和乙酸甲酯
(2)中国的酒文化渊源流长,古代人们便懂得利用粮食、果实等酿制美酒,请写出①葡萄糖转化为乙醇的化学方程式:___________________。
②乙醇催化氧化的化学方程式:______________________________。
某课外活动小组同学用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为。
(2)若开始时开关K与b连接,则其总反应的离子方程式为。
(3)若用此装置进行电解K2SO4溶液的实验,试回答以下问题:
①开关K应与连接,
②若标准状况下A极产生2.24 L气体,则溶液中转移_mol电子
③反应一段时间后,溶液的pH(填变大、变小或不变),若要电解质溶液复原,
需向溶液中加入的物质为(填化学式)。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序(用元素符号作答)
(4)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(5)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):
请填写下列空白:
(1)A,C是。
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液反应生成I和D的离子方程式是