有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是
| A.肯定有Al3+、Mg2+、Cl-,可能有NH4+ |
| B.肯定有Al3+、Mg2+、 HCO3-,肯定没有 MnO4- |
| C.肯定有Al3+、Mg2+、Cl-,可能有K+ |
| D.肯定有K+、Al3+、MnO4-,可能有HCO3- |
一定温度下,可逆反应2NO2 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是()
2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
在密闭容器中,反应X2(g)+Y2(g)  2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()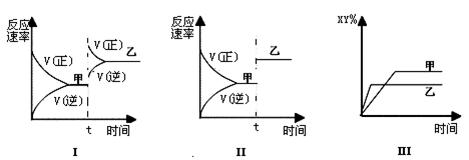
| A.图Ⅰ是加入适当催化剂的变化情况 | B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是增大压强的变化情况 | D.图Ⅲ是升高温度的变化情况 |
右图曲线a表示放热反应 X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是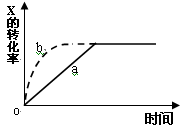
| A.升高温度 |
| B.加大X的投入量 |
| C.加催化剂 |
| D.增大体积 |
已知下列热化学方程式:
Zn(s)+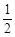 O2(g)=ZnO(s)△H =-351.1kJ·mol-1
O2(g)=ZnO(s)△H =-351.1kJ·mol-1
Hg(l)+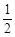 O2(g)=HgO(s)△H =-90.7 kJ·mol-1
O2(g)=HgO(s)△H =-90.7 kJ·mol-1
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为()
| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是()
| A.a mL | B.(50―a)mL | C.大于(50―a)mL | D.大于a mL |