汽车的启动电源常用铅蓄电池,电池反应如下:
PbO2 + Pb + 2H2SO4  2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
| A.PbO2放电时是电池的负极,充电时是电池的阳极。 |
B.负极的电极反应式为:Pb + SO – 2e – = PbSO4 – 2e – = PbSO4 |
| C.放电时,PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2—与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y |
B.X2Y2 | C.Z2Y2 | D.ZYX |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号[ |
X |
Y |
Z |
W |
| 原子半径/nm |
0.130 |
0.118 |
0.102 |
0.073 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.Z的氢化物的沸点比W的氢化物高
下列说法正确的是
| A.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| B.原子最外层电子数为1的元素一定处于周期表IA族 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
根据下表中四种物质的相关数据,下列分析错误的是
| CH4 |
SiH4 |
NH3 |
PH3 |
|
| 沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
| 分解温度(K) |
873 |
773 |
1073 |
713.2 |
A. NH3的沸点比PH3高的原因是NH3分子间易形成氢键
B.CH4的分解温度比SiH4高的原因是C-H 的键长比Si-H短
C.NH3的分解温度比PH3高的原因是N-H 的键能比P-H的键能小
D.由于SiH4的相对分子质量比CH4大,范德华力更强,所以SiH4沸点比CH4高
A、B均为短周期金属元素。依据下表数据判断一定错误的是
电离能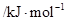 |
 |
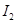 |
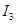 |
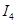 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
A.A元素的常见价态是是+2价 B.A的最高价氧化物的水化物可能是两性氢氧化物
C.电负性:A>B D.B原子的电子排布式为1s2 2s2