下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A.SO2+H2O H2SO3 H2SO3 |
| B.Cl2+H2O=HCl+HClO |
C.3Fe+4H2O(g) Fe2O4+4H2 Fe2O4+4H2 |
| D.2Na+2H2O=2NaOH+H2↑ |
已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是()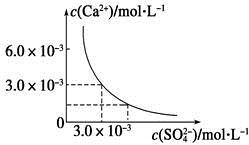
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
下列各溶液中,微粒物质的量浓度关系正确的是()
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)+c(C )+c(H+)+c(C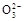 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S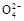 )>c(N )>c(N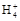 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是()
2NO+O2在密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ |
| C.①③④ | D.①②③④⑤⑥ |
下列事实不能用电化学理论解释的是()
| A.镀层被划破后,镀锌的铁制品比镀锡的铁制品耐腐蚀 |
| B.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| C.铝片不用特殊方法保存 |
| D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快 |
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是()
| A.稀NaOH溶液 | B.HCl溶液 | C.CuSO4溶液 | D.NaCl溶液 |