下列离子方程式正确的是( )
| A.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
B.磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O 9Fe3++NO↑+14H2O |
| C.100ml0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl- |
| D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
有关晶体的结构如图所示,下列说法中不正确的是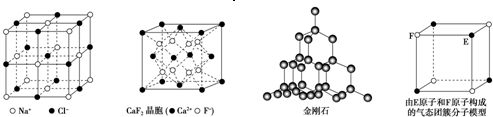
| A.在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
| B.在CaF2晶体中,每个晶胞平均占有4个Ca2+ |
| C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2 |
| D.该气态团簇分子的分子式为EF或FE |
下列晶体分类中正确的是一组是
| 离子晶体 |
原子晶体 |
分子晶体 |
|
| A |
NaOH |
Ar |
SO2 |
| B |
H2SO4 |
石墨 |
S |
| C |
CH3COONa |
水晶 |
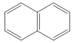 |
| D |
Ba(OH)2 |
金刚石 |
玻璃 |
氯化硼的熔点为-107℃、沸点为12.5℃,在氯化硼分子中,氯—硼—氯键角为120º,它可以水解,水解产物之一是氯化氢,下列对氯化硼的叙述中正确的是
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.硼原子以sp3杂化 |
D.水解方程式:BCl3+3H2O H3BO3+3HCl H3BO3+3HCl |
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是
①CS2与NO2②CO2与N2O③SO2与O3④PCl3与BF3
| A.①②③ | B.③④ | C.②③④ | D.②③ |
下列熔、沸点高低的比较不正确的是
| A.金刚石>碳化硅>晶体硅 | B.邻羟基苯甲酸>对羟基苯甲酸 |
| C.纯铁>生铁 | D.MgO>MgCl2 |