下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl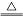 Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
C.Na2O2溶于水产生O2:Na2O2+H2O 2Na++2OH-+O2↑ 2Na++2OH-+O2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应: HC+Ca2++OH- CaCO3↓+H2O CaCO3↓+H2O |
如图为雾霾的主要成分示意图.下列说法不正确的是()
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
D.利用丁达尔效应可检验雾霾是否为胶体
下列说法错误的是()
| A.向蛋白质溶液中加入CuSO4溶液发生蛋白质变性 |
| B.煤焦油中含有苯、二甲苯等化工原料 |
| C.天然气和可燃冰的主要成分都是甲烷 |
| D.石油裂解的主要目的是为了得到更多的汽油 |
下列说法中,不正确的是()
| A.有机化合物中每个碳原子最多形成4个共价键 |
| B.油脂、淀粉、蛋白质在一定条件下都能发生水解反应 |
| C.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 |
| D.乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键 |
下列有关物质水解的说法正确的是()
| A.蛋白质水解的最终产物是多肽 | B.淀粉水解的最终产物是葡萄糖 |
| C.纤维素不能水解成葡萄糖 | D.油脂水解产物之一是甘油 |
下列关于有机化合物的性质说法正确的是()
| A.棉花和蛋白质都是高分子化合物,水解产物相同 |
| B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应 |
| C.乙酸乙酯和油脂互为同系物 |
| D.甲烷和乙醇均能发生取代反应 |