大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
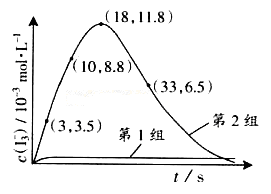
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。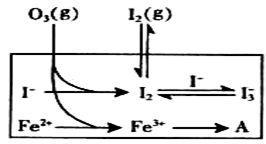
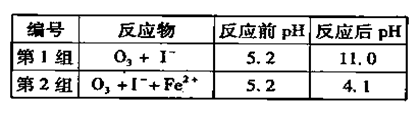
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
| A.c(H+)减小 | B.c(I-)减小 | C.I2(g)不断生成 | D.c(Fe3+)增加 |
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为:.其电极均由石墨材料做成,则电解时不断消耗的电极是;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为,正极附近溶液的pH(填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程:(△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ、铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:
有3molFeS2参加反应,转移mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式。
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是、;
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是
,BN中B元素的化合价为;
(3)在BF3分子中,F-B-F的键角是,B原子的杂化轨道类型为
,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是g•cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
某有机物X(C12H13O6Br)的分子中多种官能团,其结构简式为:
(其中Ⅰ、Ⅱ未知部分),已知X可以发生如图所示的转化
已知向X、E的水溶液中滴入FeCl3溶液均发生显色反应,E的核磁共振氢谱图中只有两个峰;G、M都能与NaHCO3溶液反应。
(1)由B转化成D的化学方程式是;
(2)G分子所含官能团名称是;
(3)E的结构简式是;
(4)F与G互为同分异构体,F的分子中只羧基、羟基和醛基三种,且同一个碳原子上不能同时连有两个羟基.则F的分子结构有种
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为,还原产物是。
(2)在上述除杂过程中,通入空气的作用是废渣的主要成分是。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是。
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y |
Y是地壳中含量最高的元素 |
| Z |
Z的基态原子最外层电子排布式为3s23p1 |
| W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第周期第族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是。氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是。