已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题: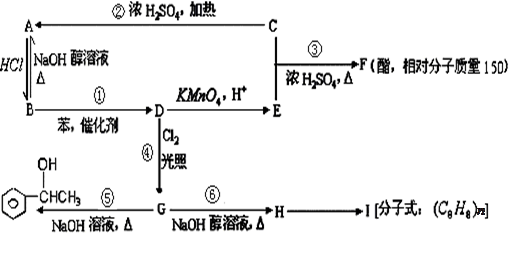 。
。
(1)D的结构简式为 ,E、H中所含官能团的名称分别是 、 。
(2)①②③④⑤⑥反应中属于消去反应的是 。
(3)写出⑥的反应方程式 。
写出H→I的反应方程式 。
(4)简述验证G中含有氯元素的方法是 。
(5)写出一种符合下列要求的F的同分异构体的结构简式;
①F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种: 。
②F的同分异构体中属于醇类,能发生银镜反应,且苯环上的一氯取代物只有两种: 。
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0 ,试回答下列问题:
CO2(g)+H2(g)△H<0 ,试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)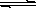 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
以乙烯为原料合成化合物C的流程如下所示: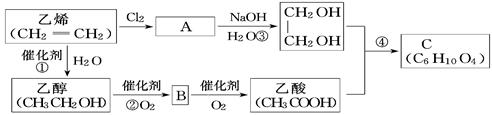
(1)B和C中含有的官能团名称分别为____________,____________。
(2)写出A的结构简式______________________________________。
(3)①③的反应类型分别为____________反应和____________ 反应。
(4)写出乙醇的同分异构体的结构简式_________________________。
(5)写出反应④的化学方程式:
________________________________________________________。
(6)写出B与新制Cu(OH)2反应的化学方程式:___________________
_____ ______。
(8分) 某烃分子式为C6H14,根据下列信息写出该烃的结构简式.
(1)若该烃不可能由炔烃与氢气加成得到,则该烃是__________________.
(2)若该烃只能由一种烯烃与氢气加成得到,则该烃是________________.
(3)若该烃可由两种烃炔与氢气加成得到,则该烃是__________________.
(4)若该烃可由三种烯烃与氢气加成得到,则该烃可能是______________.
某有机物A在氧气中充分燃烧只生成CO2和H2O,实验测定A
中C、H、O的质量比为6:1:8,则A的实验式为;质谱图表明A的相对分子质量为60,则A的分子式为_________________。
(1) 若足量A与Na2CO3反应产生CO2,此反应的化学方程式为:(有机物要求写结构简式)_____________________________________________;
(2) 若A能发生银镜反应,则其结构简式可能是:_______________、__________________。