氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 ;
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关x的说法中不正确的是
| A.X能形成化学式为X(OH)3的碱 |
| B.X可能形成化学式为KXO3的含氧酸钾盐 |
| C.X原子的最外层电子数和核电荷数肯定为奇数 |
| D.X能与某些金属元素形成化合物 |
科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价含砷化合物。下列说法中不正确的是
| A.维生素C具有还原性 |
| B.上述过程中砷元素发生还原反应 |
| C.上述过程中+5价砷类物质作氧化剂 |
| D.1mol +5价砷完全转化为+3价砷,共失去2mol电子 |
铅笔是常用的学习用品,铅笔芯的主要成分是石墨和黏土。某型号的铅笔芯质量的一半成分是石墨,用该铅笔写一个化学方程式消耗的质量约1mg,那么铅笔芯中减少的碳原子数约为
| A.2.5×1019个 | B.2.5×1022个 | C.5×1019个 | D.5×1022个 |
在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).
xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).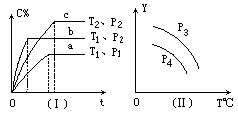
| A.p3>p4,Y轴表示A的质量 | B.p3<p4,Y轴表示B的百分含量 |
| C.p3>p4,Y轴表示混合气体密度 | D.p3>p4,Y轴表示混合气体平均摩尔质量 |
一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M %,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N %。M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M %,若在同一温度和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N %。M与N的关系是( )
| A.M>N | B.M<N | C.M=N | D.无法确定 |