为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
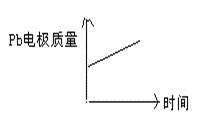
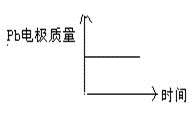
电解池:2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
| |
电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成2molAl2O3 |
| C |
正极:PbO2+4H++2e—=Pb2++2H2O |
阳极:2Al+3H2O-6e—=Al2O3+6H+ |
| D |
 |
 |
波尔多液能防治病虫害的原因是()
| A.硫酸铜使菌体蛋白质盐析 | B.石灰乳使菌体蛋白质水解 |
| C.铜离子和碱性条件使菌体蛋白质变性 | D.蛋白质可以溶解波尔多液 |
血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量约为151 000。已知该分子
中铜的质量分数为0.34%,则平均每个铜蓝蛋白质分子中的铜原子数为…( )
| A.8 | B.6 | C.4 | D.2 |
当含有下列结构片断的蛋白质在胃中水解时,不可能产生的氨基酸是( )
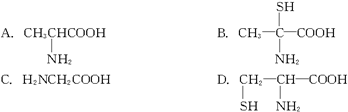
下列物质可以使蛋白质变性的是( )
①福尔马林②酒精③高锰酸钾溶液④硫酸铵⑤硫酸铜⑥双氧水⑦硝酸
| A.除④⑦外 | B.除③⑥外 | C.①②⑤ | D.除④外 |
一种称为“摇头丸”的毒品,已从国外流入我国,司法机关予以坚决查缉和打击,已知该毒品中含氮10.37%,其结构可能是()