常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是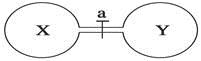
| 编号 |
① |
② |
③ |
④ |
| 气体X |
HI |
NH3 |
H2 |
NO |
| 气体Y |
Cl2 |
HCl |
Cl2 |
O2 |
A.②>③>①>④ B.③>①=④>②
C.③>①>④>② D.④>①>②>③
“神舟六号”所用动力燃料之一为氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列有关叙述中正确的是( )
A.三种物质质子数之比为1∶2∶3
B.三种物质中子数之比为1∶1∶1
C.三种物质的摩尔质量之比为8∶9∶10
D.三种物质的化学性质不同
有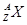 和
和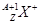 两种粒子,下列叙述正确的是( )
两种粒子,下列叙述正确的是( )
| A.一定都是由质子、中子、电子构成的 |
| B.化学性质几乎完全相同 |
| C.质子数一定相等,质量数和中子数一定不相等 |
| D.核电荷数和核外电子数一定相等 |
2011年3月11日,日本福岛核电站因为9.0级大地震引发的海啸受损,产生严重的核泄漏。核泄漏物中含放射性元素碘-131,则有关碘-131(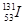 )和碘-127(
)和碘-127(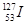 )说法正确的是( )
)说法正确的是( )
A.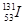 和 和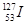 的中子数相同,是同一种核素 的中子数相同,是同一种核素 |
B.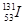 和 和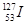 的质子数相同,互为同位素 的质子数相同,互为同位素 |
C.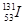 和 和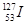 的核外电子排布方式不同 的核外电子排布方式不同 |
D.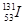 有放射性而 有放射性而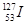 无放射性,说明两者化学性质不同 无放射性,说明两者化学性质不同 |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
A.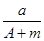 (A-N+m) mol (A-N+m) mol |
B.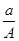 (A-N) mol (A-N) mol |
C.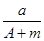 (A-N) mol (A-N) mol |
D.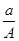 (A-N+m) mol (A-N+m) mol |
某有机物结构简式为 ,下列关于该有机物的说法中不正确的是( )
,下列关于该有机物的说法中不正确的是( )
| A.遇FeCl3溶液显紫色 |
| B.与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 mol |
| C.能发生缩聚反应和加聚反应 |
| D.1 mol该有机物与溴发生加成反应,最多消耗1 mol Br2 |