设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.1 mol Al3+离子含有的核外电子数为3NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途。下列关于铝合金具有广泛用途的分析不正确的是
| A.铝元素在地壳中的含量高,储量丰富 |
| B.铝容易形成致密的氧化膜,抗腐蚀性能好 |
| C.铝化学性质稳定,常温下不与任何酸碱反应 |
| D.铝的冶炼技术基本成熟,可以大量生产 |
下列关于钠的化合物的说法中,正确的是
| A.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 |
| B.Na2CO3固体中含有的NaHCO3可用加热的方法除去 |
| C.Na2O2和Na2O均为白色固体,与CO2反应均放出O2 |
| D.分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
化学在生产和日常生活中有着重要的应用,下列说法不正确的是
| A.氧化镁用作耐火材料 |
| B.Na2O常用于潜水艇或呼吸面具的供氧剂 |
| C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| D.FeCl3溶液可用于刻制印刷铜电路板 |
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下: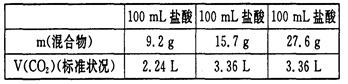
则下列结论中不正确的是()
| A.盐酸物质的量浓度为1.5 mol/L, | B.15.7g混合物与盐酸反应后有剩余 |
| C.加入9.2 g混合物时消耗HCl 0.1 mol | D.混合物中NaHCO3和KHCO3的质量比为1:1 |
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是 ( )
| A.该反应中Fe2+是还原剂,O2是还原产物 |
| B.4 mol Na2O2在反应中共得到8NA个电子 |
| C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子 |
| D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |