为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(1)装置B的作用是 。
(2)经小组讨论并验证该无色气体为O2,其验证方法是 。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有 。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2+ + MnO4— + 8H+= 5Fe3+ + Mn2+ + 4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需
要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________________。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是____________。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。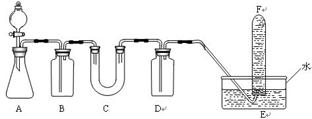
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________。
(2)填写表中空格:(请在答题卡上填空)
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:。
(4)试管F中收集满气体后,下一步实验操作是:。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。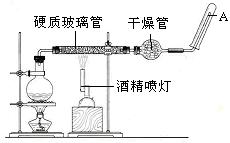
(1)写出该反应的化学方程式,其中氧化剂是,还原剂是。8.4g铁粉参加反应,转移电子mol。
(2)玻璃管中石棉绒的作用是,实验开始时应先点燃,实验结束时应先熄灭。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部应事先放置,其作用是。
(6分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
⑶取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有,一定不含有,可能含有。
用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸倒入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
⑴第步操作中应用量筒量取mL浓硫酸;应选择mL量筒(填5、10或50)
⑵本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是、、。(可以不填写满)
⑶正确的操作顺序是(用序号填写)。
⑷定容时,如果俯视刻度线,配制的硫酸浓度将偏 (填大或小)