天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效。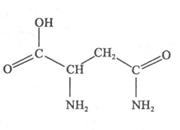
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见表。
| 化学式 |
键长/nm |
键角 |
沸点/℃ |
| H2S |
1.34 |
92.3o |
一60.75 |
| H2Se |
1.47 |
91.0o |
一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
| 编号 |
I5/kJ·mol-1 |
I6/kJ·mol-1 |
I7/kJ·mol-1 |
I8/kJ·mol-1 |
| A |
6990 |
9220 |
11500 |
18770 |
| B |
6702 |
8745 |
15455 |
17820 |
| C |
5257 |
6641 |
12125 |
13860 |
A是 (填元素符号),B的价电子排布式为 。
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末达到平衡且测得容器中有1.6 mol SO2 ,回答下列问题:
(1)写出容器内发生反应的化学方程式;
(2)2 min内SO2的平均反应速率________________________。
(3)达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
④容器内的压强恒定不变
(4)平衡时容器内的压强是开始的倍。
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
BAD的合成路线如下: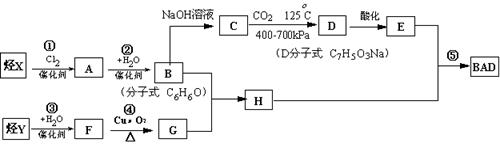
试回答:
(1)写出结构简式Y ________________________ D____________________。
(2)属于取代反应的有_____________________________(填数字序号) 。
(3)1molBAD最多可与含____mol NaOH的溶液完全反应
(4)写出反应④方程式_______________________________________________
(5)写出B+G→H方程式________________________________________________。
(6)E的同分异构体有下列性质:①与FeCl3反应,溶液呈紫色;;②能发生银镜反应,则该同分异构体共有种。
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高 价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子的空间构型为 。
。
②反应I的化学方程式为。
③化合物NaX3是合成“达菲”的中间活性物质,NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式。
(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120g·mol—1,则:
①将反应IV所得的溶液加热蒸干得到的晶体属于晶体(填“离子”、“分子”、“原子”)
②反应I的化学方程式为。
③含Y元素的化合物Na2Yx和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,请写出该反应的离子反应方程式。
某有机物甲和A互为同分异构体,经测定它们的相对分子质量小于100;将1mol甲在O2中充分燃烧得到等物质的量的CO2和H2O (g) ,同时消耗112LO2(标准状况);在酸性条件下将1 mol甲完全水解可以生成1 mol 乙 和1mol丙 ;而且在一定条件下,丙可以被连续氧化成为乙。
经红外光谱测定,在甲和A的结构中都存在C=O双键和C-O单键,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
⑴请确定并写出甲的分子式;E → F 的反应类型为反应;
⑵A的结构简式为;G 的结构简式为;
⑶B →D的反应化学方程式为;
⑷写出C在条件①下进行反应的化学方程式。
⑸有机物丁也与甲互为同分异构体,请写出同时满足下列条件的丁的所有可能的结构简式;
①可以与新制的Cu(OH)2悬浊液共热生成砖红色沉淀;②氢的核磁共振谱图显示有3种峰。