下表为各物质中所含少量杂质以及除去这些杂质所选用的试剂或操作方法,正确的是
| 序号 |
物质 |
杂质 |
除杂质应选用的试剂或操作方法 |
| ① |
KNO3溶液 |
KOH |
加入FeCl3溶液,并过滤 |
| ② |
Al2(SO4)3溶液 |
MgSO4 |
加入过量烧碱后过滤,再用硫酸酸化滤液 |
| ③ |
CH4 |
C2H4 |
通过盛有酸性高锰酸钾溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ |
NaNO3 |
CaCO3 |
溶解、过滤、蒸发结晶 |
A.④ B.③④ C.①④ D.②③
下列氯化物既可有金属与氯气直接反应制得,也可由金属与盐酸反应制得的是
| A.CuCl2 | B.FeCl3 | C. FeCl2 FeCl2 |
D.AlCl3 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是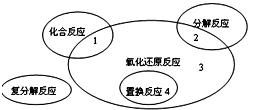
|
| A.Cl2+2KBrBr2+2KCl |
B.2NaHCO3Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O4Fe(OH)3 | |
| D.2Na2O2+2CO22Na2CO3+O2 |
2009年10月1日为庆祝祖国60华诞的联欢晚会在北京天安门广场举行,当晚8时许,璀璨的焰花从天安门广场四面八方腾空而起、交相辉映,把整个联欢晚会现场烘托得热烈喜庆。其中开篇"60"字样的高空焰火,象征民族大团结的56个“笑脸”、60支和平鸽让数万观众眼前为之一亮。这些都与高中化学中“焰色反应”知识相关。下列说法中正确的是
| A.焰色反应均应透过蓝色钴玻璃观察 |
| B.NaC1与Na2CO3灼烧时火焰颜色相同 |
| C.非金属单质燃烧时火焰均为无色 |
| D.所有金属及其化合物灼烧时火焰均有颜色 |
“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液②具有介稳性③能产生丁达尔效应④属于 分散系⑤不能透过滤
分散系⑤不能透过滤 纸⑥静止后会出现黑色沉淀。其中正确的是
纸⑥静止后会出现黑色沉淀。其中正确的是
| A.①④⑥ | B.②③⑤ | C.②③④ | D.①③④⑥ |
某有机物的结构简式为 ;它不可以发生的反应类型有:①取代②加成③消去④水解⑤酯化⑥中和⑦氧化⑧加聚
;它不可以发生的反应类型有:①取代②加成③消去④水解⑤酯化⑥中和⑦氧化⑧加聚
| A.④⑦⑧ | B.①⑤⑦ | C.⑧ | D.①② |