25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是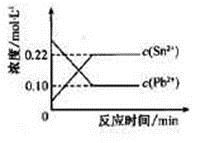
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
下列与有机物结构、性质相关的叙述错误的是
| A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| B.蛋白质和油脂都属于高分子化合物,一定条件下能水解 |
| C.甲烷和氯气反应生成一氯甲烷、苯和硝酸反应生成硝基苯的反应类型相同 |
D.苯 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
下列有关说法中正确的是
| A.HCl气体管道是否存在泄漏,可用醮有浓氨水的棉球进行检查 |
| B.电解水生成H2和O2的实验中,可加入少量盐酸或硫酸增强导电性 |
| C.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率 |
| D.升高温度能使吸热反应速率加快,使放热反应速率减慢 |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g);ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g);ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是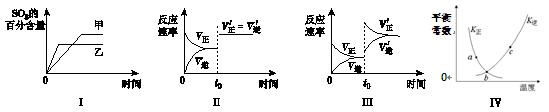
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态. |
Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源。电池的总反应可表示为:Mg+2AgCl=MgCl2+2Ag。下列关于该电池说法错误的是
| A.该电池工作时,正极反应为:2AgCl+2e-=2Cl-+2Ag |
| B.镁电极作该电池负极,负极反应为:Mg-2e-=Mg2+ |
| C.当有24g Mg被氧化时,有108 g Ag被还原 |
| D.装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
下列分子或离子在无色透明的溶液中能大量共存的是
| A.Na+、H+、SO32-、HClO | B.Al3+、Mg2+、OH-、CO32- |
| C.K+、OH-、Cl-、NH3·H2O | D.Ba2+、Fe3+、NO3-、Cl- |