下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4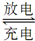 2PbSO4+2H2O。电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4+2H2O。电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )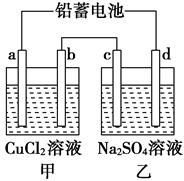
| A.d极为阴极 |
| B.放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42—+2e-===PbSO4+2H2O |
| C.若利用甲池精炼铜,b极应为粗铜 |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生标准状况下的气体3.36 L |
下列叙述正确的是( )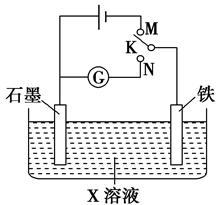
| A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e-===H2↑ |
| C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 |
| D.K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-===2H2O+O2↑ |
(2012年高考安徽卷)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1NaOH溶液。下列有关说法正确的是( )
| A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) ΔH=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mo |
平衡时反应中 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达到平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)  2C(g);ΔH>0,平衡移动关系如下图所示。下列说法正确的是( )
2C(g);ΔH>0,平衡移动关系如下图所示。下列说法正确的是( )
| A.p1<p2,纵坐标指A的质量分数 |
| B.p1>p2,纵坐标指C的质量分数 |
| C.p1<p2,纵坐标指A的转化率 |
| D.p1<p2,纵坐标指混合气体的平均摩尔质量 |