实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
| A.仅有② | B.仅有②④ | C.仅有②③④ | D.全部符合要求 |
盐的水解程度大小可以用“水解度”来表示。关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2L1mol·L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是
| A.0.01% | B.0.1% | C.0.2% | D.1% |
现有下列一些常见的仪器:①大、小烧杯,②容量瓶,③量筒,④环形玻璃搅拌棒,⑤试管,⑥温度计,⑦蒸发皿,⑧托盘天平。在测定稀盐酸和氢氧化钠稀溶液中和热的实验中,不需要使用的仪器有
| A.①②⑥⑦ | B.②⑤⑦⑧ | C.②③⑦⑧ | D.③④⑤⑦ |
根据下列电子排布,处于激发态的原子是
| A.1s22s22p6 | B.1s22s22p63s1 | C.[Ar]3d14s2 | D.1s22s23s1 |
对于化学反应能否自发进行,下列说法中不正确的是 ()
| A.若ΔH<0,△S>0,任何温度下都能自发进行 |
| B.若ΔH>0,△S<0,任何温度下都不能自发进行 |
| C.若ΔH>0,△S>0,低温时可自发进行 |
| D.若ΔH<0,△S<0,低温时可自发进行 |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来。下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。该电池工作时,有关说法正确的是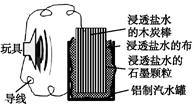
| A.铝罐将逐渐被腐蚀 |
| B.石墨颗粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.炭棒应与玩具电极的负极相连 |
| D.该电池工作一段时间后炭棒和石墨颗粒的质量会减轻 |