25°C下列各组间一定能大量共存的是
| A.pH=1的溶液:Na+、CO32-、Cl-、Ca2+ |
| B.水电离的c(H+)=1.0×10-13的溶液:K+、HCO3-、SO42-、NH4+ |
| C.c(OH-)/c(H+)=1.0×10—12的溶液:Fe2+、NO3-、K+、Cl- |
| D.含有Ba2+离子溶液:AlO2-、Na+、NO3-、NH4+ |
下列有机化合物的分类不正确的是( )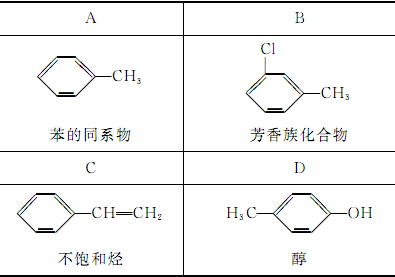
下列分子中的官能团相同的是( )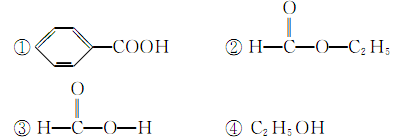
| A.①和② | B.③和④ | C.①和③ | D.②和④ |
下列物质中,属于醇类的是( )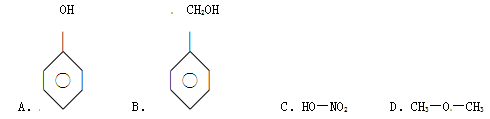
2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A.点燃,能燃烧的是矿物油 |
| B.测定沸点,有固定沸点的是矿物油 |
| C.加入水中,浮在水面上的是地沟油 |
| D.加入足量氢氧化钠溶液共热,不分层的是地沟油 |
有机化学的研究领域是( )
①有机物的组成 ②有机物的结构、性质 ③有机合成 ④有机物的应用
| A.①②③④ | B.①②③ |
| C.②③④ | D.①②④ |