高温下,某反应达平衡,化学平衡常数表达式为: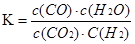 ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
在有机反应类型中,很多是交叉的,或是包含的,如CH3COOH+HOC2H5 CH3COOC2H5+H2O,既属于酯化反应又属于取代反应。下列反应类型中既不存在交叉关系,又不存在包含关系的是()
CH3COOC2H5+H2O,既属于酯化反应又属于取代反应。下列反应类型中既不存在交叉关系,又不存在包含关系的是()
①取代②加成③硝化④酯化⑤加聚⑥缩聚⑦消去⑧脱水⑨聚合⑩裂化
| A.⑧ | B.⑨ | C.⑩ | D.③ |
下列关于乙酸的说法中,不正确的是()
| A.乙酸是一种重要的有机酸,是具有刺激性气味的液体 |
| B.乙酸分子里含有4个氢原子,所以乙酸不是一元酸 |
| C.无水乙酸又称冰醋酸,它是纯净物 |
| D.乙酸易溶于水和乙醇 |
一定量的某有机物溶解于适量的NaOH溶液中,滴入酚酞,溶液呈红色,煮沸5 min后,溶液的颜色逐渐变浅,再加入盐酸呈酸性时,沉淀出白色晶体。取少量晶体放入FeCl3溶液中,溶液呈紫色,则该有机物可能是()
溶质质量分数为3x%和x%的两种硫酸等体积混合后,混合液中溶质的质量分数是()
| A.2x% | B.大于2x% |
| C.小于2x% | D.无法计算 |
炭和CaCO3的混合物在空气中受强热后,CaCO3完全分解,炭完全氧化。如果生成的CO2总质量等于混合物的总质量,则混合物中炭的质量分数为()
| A.82.6% | B.17.4% |
| C.21.5% | D.54.3% |