碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )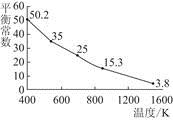
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
下列微粒:① ;②
;② ;③
;③ ;④
;④ 。其中核外电子数相同的是( )
。其中核外电子数相同的是( )
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
已知下列元素的原子半径为
| 原子 |
 |
 |
 |
 |
半径 m m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是()
A. m B.
m B. m C.
m C. m D.
m D. m
m
在元素周期表中,第一、二、三、四周期元素的种类分别是()
| A.2、8、8、18 | B.2、8、18、18 |
| C.2、18、18、18 | D.2、8、18、32 |
下列关于碱金属元素和卤素的说法中,错误的是()
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
下列各表为周期表的一部分(表中为原子序数),其中正确的是()
| 2 |
2 |
3 |
4 |
6 |
6 |
7 |
||||||||
| 11 |
11 |
11 |
12 |
13 |
14 |
|||||||||
| 19 |
19 |
24 |
31 |
32 |
A、B、 C、 D、