下列有关热化学方程式的评价合理的是( )
| |
实验事实 |
热化学方程式 |
评价 |
| A |
已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 |
H2SO4(aq)+Ba(OH)2(aq) =BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 |
正确 |
| B |
醋酸与稀氢氧化钠溶液混合 |
CH3COOH(aq)+NaOH(aq) =CH3COONa(aq)+H2O(l) △H=-57.3kJ·mol-1 |
不正确;因为醋酸状态为“aq”,而不是“l”。 |
| C |
160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ |
SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1 |
不正确;因为反应热为△H=-260.6kJ·mol-1 |
| D |
已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ |
C(s)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 |
不正确;同素异形体要注名称:C(石墨) |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是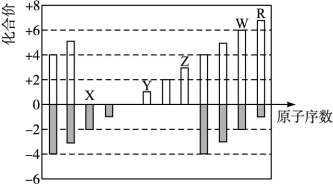
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R<W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是
| A.AgNO3 | B.NaOH | C.BaCl2 | D.Ba(OH)2 |
关于硝酸的说法正确的是
| A.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水 |
| C.硝酸与金属反应时,主要是+5价的氮元素得电子 |
| D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
| A.非金属性比硫强 | B.原子序数为34 |
| C.氢化物比HBr稳定 | D.最高价氧化物的水化物显碱性 |
下列关于化学键的说法正确的是
| A.由非金属元素组成的化合物不一定是共价化合物 |
| B.非极性键只存在于双原子分子中 |
| C.构成单质分子的微粒一定含有共价键 |
| D.不同元素组成的多原子分子里的化学键一定是极性键 |