下列反应中转移电子的物质的量不等于2 mol的是
| A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B.1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C.1 mol MnO2与含2 mol H2O2的双氧水反应 |
| D.1 mol Cu与含2 mol H2SO4的浓硫酸共热 |
常温下,下列各组微粒在指定溶液中一定能大量共存的是
| A.Kw/C(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
| B.0.1 mol/L AgNO3溶液:H+、K+、SO42-、I- |
| C.加入苯酚显紫色的溶液:K+ 、NH4+、Cl-、I- |
| D.甲基橙呈红色的溶液中:MnO4- 、Al3+ 、C2H5OH 、SO42- |
下列有关实验原理或实验操作正确的是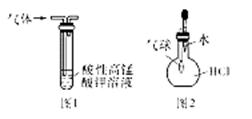
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| C.用图1装置除去乙烷中混有的乙烯 |
| D.用图2装置能验证HCl气体在水中的溶解性 |
下列叙述不正确的是
| A.根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。则下列叙述正确的是
A.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6 kJ/mol
B.C—H键键长小于H—H键
C.C≡C键能为796.0 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g) B(g)+C(g);ΔH =-48.25 kJ·mol-1
B(g)+C(g);ΔH =-48.25 kJ·mol-1
反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,下列结论正确的是
A.该温度下此反应的平衡常数为3.2B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJD.反应达平衡时,A的转化率为80%